Thèse présentée à Docteur es Sciences Physiques
pour obtenir le grade de Docteur-Ingénieur
par ¶
Bernard Cochet
Synthèses de l'acide trans-chrysanthémique et de
l'acide nor-trans-chrysanthémique
soutenue le 8 juin 1963
devant la commission d'examen :
Le pyréthre que l'on
extrait des fleurs de «chrysanthemum cinerariaefolium» et «chrysanthemum
coccineum» présente des propriétés insecticides remarquables. Les travaux de STAUDiNGER
et de RUZICKA, puis de LAFORGE déterminèrent sa composition. Il s'agit d'un
mélange de quatre esters : la Pyréthrine I, la Pyréthrine II, la Cinérine I,
la Cinérine II.
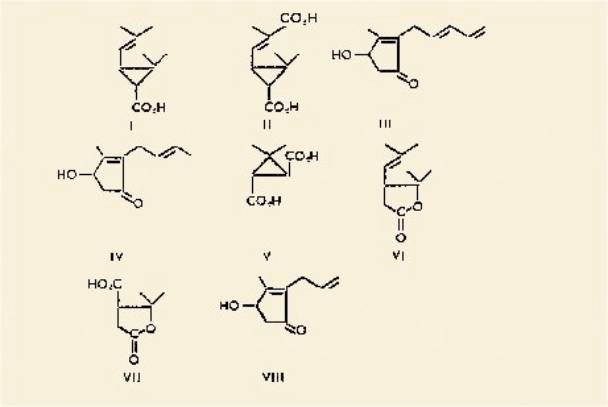
L'hydrolyse alcaline de ce mélange donne deux acides :
l'acide Chrysanthémique (I) et l'acide Chrysanthémique dicarboxylique (II)
puis deux alcools: la Pyréthrolone (III) et la Cinérolone (IV). L'acide
Chrysanthémique naturel est le (+)-trans et sa structure fut déterminée par
ozonolyse qui donne l'acide (—)-trans caronique (V) et de l'acétone. Chauffé
sous vide, il se produit une ouverture du cyclopropane et formation d'une
lactone : la (—) pyrocine (VI). Il fut alors possible de déterminer la
configuration absolue de l'acide (+)-trans-chrysanthémique en reliant au
glycéraldéhyde l'acide (+)térebique (VII) obtenu par ozonolyse de la
(-)pyrocine.
La biogenèse de l'acide
Chrysanthémique fut élucidée par THAIN qui incorpora de l'acide (2-C14)
mévalonique dans la pyréthrine in vivo. Après hydrolyse, la radio-activité se
retrouve uniquement dans la fraction acide. La position des carbones
radioactifs déterminés par dégradation montre que l'acide Chrysanthémique est
obtenu par fusion de deux unités isopréniques suivant un mécanisme proche de
l'addition des carbones sur une double liaison :
A la suite des travaux de
RUZICKA et d'HARPER, la méthode la plus courante de préparation de l'acide
Chrysanthémique est l'addition du diazoacétate d'éthyle sur le diméthyl-2,5
hexadiène-2,4. L'acide obtenu est un mélange des isomères cis et trans séparables
par cristallisation. La résolution optique faite par les sels de quinine ou
(+)a-phényl-éthylamine rendit possible la relation entre l'acide de synthèse
et le (+)-trans naturel. Récemment, on a montré que l'addition du carbene sur
le diène précédent donnait le même mélange d'isomères.
L'activité insecticide des
esters est reliée à la configuration de l'acide et pour un même alcool, les
esters de l'acide (±)-trans sont de bien meilleurs insecticides que ceux du
(±)-cis. Les recherches s'orientèrent vers une synthèse stéréospécifique
donnant plus de produits actifs. HARPER en additionnant le diazoacétonitrile
au tétra-méthyl-butadiène obtenait les nitriles chrysanthémiques isomères
transformés par hydrolyse en acide (±)-trans. Plus récemment, JULIA et JEANMART
à partir de la pyrocine, obtenue par une nouvelle méthode, préparèrent un
g-chloro-ester qui fut cyclisé par le t-amylate en ester (±)-trans
Chrysanthémique.
Les méthodes générales de
synthèses des cyclopentenolones développées par LAFORGE puis par CROMBIE et
HARPER permirent de préparer après les pyréthrolones et les cinérolones des
alcools plus simples qui, estérifiés par l'acide Chrysanthémique, donnaient
des esters d'activité insecticide comparable au pyréthre naturel. Ainsi
l'allyl-réthrolone (VIII) donne un ester prépare industriellement connu sous
le nom «d'allethrine». Cependant on a montré que des alcools simples de
structures totalement différentes comme les alcools de chloro-6 ou
bromo-6-pipéronyliques donnaient des esters d'activité intéressante.
En réalisant une synthèse
stéréospécifique de l'acide (±)-trans-chrysanthémique où l'emploi du
diazoacétate d'éthyle était exclu, on supprimait deux inconvénients de la
synthèse initiale : l'utilisation d'un réactif dangereux et la production d'acide
(±)-cis d'activité plus faible. Mots clefs :
chrysanthemum / acide / activité / alcool / allethrine / amylate / chrysanthémique /
cinerariaefolium / cinérine / cinérolone / crombie / diazoacétate / diazoacétonitrile /
dicarboxylique / diméthyl / ester / éthyle / harper / hydrolyse / insecticide / isopréniques /
jeanmart
julia / laforge / méthode / mévalonique / ozonolyse / pipéronylique / pyréthre / pyréthrine /
pyréthrolone / pyrocine / quinine / réthrolone / ruzicka / staudinger / stéréospécifique /
structure / synthèse / térebique / thain / cochet / wiemann
Wiemann, J., président
Julia, M., Cadiot, P., examinateurs
INTRODUCTION